
¡Sumo si, karate no!
Por: Lionel Valenzuela Perez
¡Que es la sumoilación, que alguien me lo expliqueeeeeeeee!
Paciencia jóvenes padawan (es que hoy vi “La venganza de los Siths”).
La sumoilación es una modificación post-traduccional, reversible, que tiene como objetivo unir covalentemente una o mas proteínas SUMO a un aminoácido lisina de una proteína blanco. La proteína blanco queda de esta forma “etiquetada” y preparada para diferentes procesos biológicos.
Se llama SUMO (small ubiquitin-like modifier) a una familia de pequeñas proteínas que modifican covalentemente a otras proteínas, en forma similar a como lo hace la ubiquitina. De allí su denominación en ingles y el acrónimo.
Así como la modificación postraduccional llevada acabo por la ubiquitina se la denomina ubiquitinización a la modificación realizada por la proteína SUMO se la llama sumoilación.
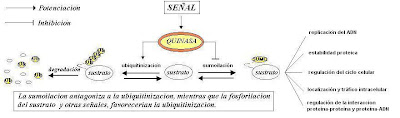
Recordemos que la ubiquitinización es conocida como una señal de degradación. Cuando la proteína blanco es ligada a la ubiquitina, es reconocida por el proteasoma de 26S y luego degradada.
Procesos regulados por la sumoilación
La unión de la proteína SUMO al aminoácido lisina de la proteína sustrato es reversible ya que existe una familia de proteasas específicas, denominadas SENP (por sentrina proteasas), capaces de remover a SUMO de la proteína que etiquetaba. SUMO altera las propiedades bioquímicas de la proteína conjugada. Regulando de esta forma, entre otros procesos:
- localización y trafico intracelular
- estabilidad proteica e interacción proteína-proteína
- actividad transcripcional e interacción proteína-ADN
- señalización y transporte nucleo-citoplasmático
- replicación del ADN
- regulación del ciclo celular
- regulación de la replicación viral
- ubiquitinización (recientemente reportado)
En cuanto a su estructura SUMO es una proteína de 97 aminoácidos que posee homología con la ubiquitina. Ambas proteínas Sumo y la ubiquitina se unen a la misma secuencia consenso. Por lo tanto podría haber una competencia entre ambos procesos. Si una proteína es sumoilizada no podría luego ser ubiquitinizada, a menos que antes, SUMO, fuera removida por una proteasa específica. En concordancia con este razonamiento, algunos ejemplos demuestran que la ubiquitinización y la sumoilación de algunas proteínas podrían ser procesos antagónicos.
Definición de sumoilación
Definiremos a la sumoilación como un proceso reversible de modificación postranscripcional, que regula la actividad de las proteínas unidas covalentemente a la proteína SUMO.
La sumilación consta de 4 pasos, en forma similar a la ubiquitinización, estos son:
1- Maduración: la proteína sumo es activada por una peptidasa.
2- Activación: unión a la enzima activadora E1, proceso dependiente de ATP
3- Conjugación: transferencia de SUMO desde la enzima E1 a la proteína conjugadora E2 (UBC9).
4- Ligadura: Las enzimas E3 son las responsables de regular la unión de SUMO a sus proteínas sustrato. Realizan este proceso uniéndose tanto a la enzima conjugadora E2 como a la proteína sustrato. De esta forma pueden estimular la transferencia del modificador.
La sumoilación y la segregación de los cromosomas
Como señalamos anteriormente la sumoilación utiliza una sola enzima conjugadora, denominada E2 (UBC9), para unir la proteína SUMO a sus sustratos. Estudios recientes indican que si la sumoilación falla por una mutación en UBC9, la viabilidad de los embriones se ve comprometida, ya que esta vía estaría involucrada en la estabilidad y segregación de los cromosomas.
Las levaduras con la proteína SUMO mutada muestran problemas en la mitosis y en la segregación de los cromosomas. Se ha establecido que la sumoilación es esencial para reclutar y retener las proteínas del cinetocoro.
Estos y otros ejemplos implican a la sumoilación como un importante factor en la segregación de los cromosomas y por lo tanto en la división celular.
El transporte núcleo-citoplasmático es regulado por la sumoilación
Sabemos que la proteína Ran juega un importantísimo papel en el transporte a través del complejo del poro nuclear (CPN).
La actividad de la proteína Ran depende a su vez de la proteína activadora 1 de
Esta proteína RanGAP1 una vez sumoilizada es transportada al CPN, donde activa a la proteína RAN permitiendo un transporte nucleo-citoplasmático normal. Pero si la sumoilación de RanGAP1 falla, no es transportada luego al CPN y se altera todo el transporte entre el núcleo y el citoplasma.
Por lo tanto la sumoilación es determinante en el transporte nuclear.
La respuesta celular a la hipoxia y la sumoilación
La hipoxia, es una condición potencialmente peligrosa, donde la concentración de oxigeno es muy baja y que requiere una respuesta adaptativa muy rápida del metabolismo celular.
Condiciones de hipoxia pueden encontrarse en los tumores (a medida que el tumor crece, las células en el interior de la masa tumoral reciben menos oxigeno y sufren necrosis), así como en el desarrollo embrionario normal.
La hipoxia dispara una importante respuesta transcripcional que promueve el desarrollo vascular (nuevos vasos sanguíneos, angiogénesis) así como la formación de nuevos eritrocitos (eritropoyesis). La hipoxia también potencia la glucólisis a través del aumento de la trascripción de los genes Glut-1 que codifican transportadores de glucosa.
¿Cuál es el gen regulador maestro de la hipoxia?
El gen regulador maestro de la hipoxia, es el factor inducible por la hipoxia (HIF). El HIF consiste de dos subunidades, una de las cuales,
Si las condiciones son de hipoxia, HIFα escapa a la degradación, aumentando la trascripción de los genes responsables del desarrollo de los vasos sanguíneos como el del factor de crecimiento del endotelio vascular (VEGF) y del aumento de la eritropoyesis, vía estimulación de la síntesis de la eritropoyetina (Epo).
¿Cuál es el papel de la sumoilación en la hipoxia?
Algunos trabajos, reportan que en condiciones de hipoxia, el HIFα es sumoilizado, esto aumentaría su estabilidad e impediría que fuera degradado vía ubiquitinización (ver mas arriba, la ubiquitinización y la sumoilación como procesos antagónicos). De esta forma el HIFα, escapa a la degradación activando la trascripción de los genes necesarios para corregir la situación de hipoxia.
Un importante descubrimiento de investigadores argentinos
Recientemente en la revista CELL, un equipo de investigadores argentinos, dirigidos por el investigador Eduardo ARTZ, describe el descubrimiento de un nuevo regulador de HIFα.
Este nuevo regulador llamado RSUME (por RWD-containing Sumoylation Enhancer), es decir potenciador de la sumoilación que contiene el dominio RWD (un dominio específico para las interacciones proteína-proteína), también es inducido por hipoxia.
Por lo tanto en hipoxia RSUME se sobreexpresa, potenciando la sumoilación de HIFα, aumentando su estabilidad y escapando a la degradación. Al poder acumularse HIFα en el núcleo este termina induciendo entre otros al VEGF, para que comience la angiogénesis y pueda llegar mas oxigeno al tumor.
Por lo tanto al potenciar la sumoilación de HIFα y prevenir su degradación, RSUME es un importante factor en la supervivencia del tumor cuando este crece y las células de su interior sufren de hipoxia. Si pudiera bloquearse la función de RSUME, entonces el tumor podría detener su crecimiento.
Nuevos trabajos entran en conflicto con reportes previos
En un excelente ejemplo de cómo funciona el trabajo científico, solo un mes después de la publicación del descubrimiento de RSUME, un equipo norteamericano dirigido por Edward Yeh, entrega otra visión de la regulación de HIFα, que por lo menos parcialmente contrasta con los conocimientos previos.
En estos trabajos, se muestra que es necesario que una proteasa,
Durante la embriogénesis, uno de los disparadores para la eritropoyesis es la hipoxia fisiológica que se produce durante el crecimiento del embrión. Nuevamente es HIFα el regulador maestro, que induce tanto la angiogénesis como la eritropoyesis.
Este grupo de investigadores, demostró que si la desumoilación falla (por ejemplo si el gen de la proteasa es mutado), no se produce la eritropoyesis normal y los embriones mueren. Por lo tanto la estabilización de HIFα no se produciría mediante la sumoilación sino por la desumoilación. Es mas, según el grupo de Yeh, la sumoilación de HIFα, promueve su degradación vía ubiquitinización.
Estas investigaciones del equipo de Yeh, de
Como vemos este trabajo muestra contrastes con lo reportado por el equipo de Eduardo Artz.
Pero de esta forma, con dos o más hipótesis diferentes que compiten, y múltiples grupos de investigación involucrados, que seguramente profundizarán y ampliarán nuestro conocimiento sobre los reguladores maestros del metabolismo celular como el HIF.



